Натрий
Един от жизненоважните елементи в природата е натрият Nа. По разпространение в земната кора е на шесто място. Той не се среща в свободно състояние, а в свързано под формата на различни съединения, като натриев хлорид NaCl (каменна сол, готварска сол, халит); натриев нитрат NaNO3 (минерална тор, наречена чилска селитра) и др.
Физични свойства
Простото вещество на елемента натрий Nа е в твърдо състояние. Натрият е сребристобяло вещество със силен метален блясък. Той е по-лек от водата, мек и пластичен – лесно се реже с нож. Нискотопим е в сравнение с температурата на топене на други метали като желязо, цинк и мед. Притежава много добра електропроводимост и топлопроводност.
Тези физични свойства определят натрия като метал.

Течният натрий служи за топлопреносител в някои атомни реактори в атомната енергетика. Използва се в специални газови неонови лампи, които са мощен източник на светлина, много икономични и с висок коефициент на полезно действие.

Химични свойства
Химичните свойства на натрия са взаимодействието му с различни вещества. При тези взаимодействия атомите на метала Nа отдават по 1 електрон и се превръщат в положителни натриеви йони със заряд 1+:
[latex]\large \underset{\textcolor{RoyalBlue}{\text{натриев атом}}}{\text{Nа}} - \underset{\textcolor{RoyalBlue}{електрон}}{1 е^–} \xrightarrow[\text{}]{\text{}} \underset{ \textcolor{RoyalBlue}{\text{натриев положителен йон}}}{\text{Nа}^+}[/latex]
Натриевите йони присъстват в малки количества в растенията, животните и човека.
В съединенията, които образува Nа, той е винаги от постоянна първа валентност.
Натрият Nа взаимодейства с кислорода O2 на студено, при което се получава съединението динатриев оксид Nа2O.
[latex]\large 4\text{Nа} + \text{O}_2 \xrightarrow[\text{}]{\text{}} \underset{\textcolor{RoyalBlue}{\text{динатриев оксид}}}{2\text{Nа}_2\text{O}}[/latex]
При обикновена температура и при горене в кислородна среда Nа образува с кислорода съединението Nа2O2.
[latex]\large 2\text{Nа} + \text{O}_2 \xrightarrow[\text{}]{\text{}} \underset{\textcolor{RoyalBlue}{\text{натриев пероксид}}}{\text{Nа}_2\text{O}_2}[/latex]
На тези химични реакции се дължи потъмняването на отрязано парче натрий на въздуха.
Именно затова натрият се съхранява в петрол.
 Голямо е приложението на натриевия пероксид Nа2O2 за възстановяване и пречистване на въздуха в затворени помещения (подводници, космически кораби и скривалища). Пероксидът свързва отделения при дишането CO2, като при реакцията се отделя кислород:
Голямо е приложението на натриевия пероксид Nа2O2 за възстановяване и пречистване на въздуха в затворени помещения (подводници, космически кораби и скривалища). Пероксидът свързва отделения при дишането CO2, като при реакцията се отделя кислород:
2Na2O2 + 2CO2 →2Na2CO3 + O2

Натрият реагира активно с неметали като хлор Cl2, сяра S и др.
[latex]\large 2\text{Nа} + \text{Cl}_2 \xrightarrow[\text{}]{\text{}} \underset{\textcolor{RoyalBlue}{\text{натриев хлорид}}}{2\text{Nа}\text{Cl}}[/latex]
При нагряване на натрий и стрита на прах сяра се получава съединението динатриев сулфид Nа2S.
[latex]\large 2\text{Nа} + \text{S} \xrightarrow[\text{}]{\text{}} \underset{\textcolor{RoyalBlue}{\text{динатриев сулфид}}}{\text{Nа}_2\text{S}}[/latex]
Натрият и съединенията му оцветяват пламъка в жълт цвят. 
 През януари 1959 г. е изстрелян първият космически апарат от Земята към Луната – руския спътник „Луна 1“. На небосклона се забелязва необичайна изкуствена комета с дължина от 113 000 m. Тя има яркожълт цвят от изпуснатите пари на натрия, които светят толкова ярко, че позволяват с невъоръжено око да се следи движението на спътника. Така елементът натрий „свързва съдбата си с космическото летене“.
През януари 1959 г. е изстрелян първият космически апарат от Земята към Луната – руския спътник „Луна 1“. На небосклона се забелязва необичайна изкуствена комета с дължина от 113 000 m. Тя има яркожълт цвят от изпуснатите пари на натрия, които светят толкова ярко, че позволяват с невъоръжено око да се следи движението на спътника. Така елементът натрий „свързва съдбата си с космическото летене“.

Веществата натриев хлорид NаCl и динатриев сулфид Nа2S са вид химични съединения, наречени соли. Солите са различни видове според състава и свойствата си.
 Натрият присъства в състава на различни лекарствени препарати. Много антибиотици са използват в медицината във вид на натриеви соли.
Натрият присъства в състава на различни лекарствени препарати. Много антибиотици са използват в медицината във вид на натриеви соли.
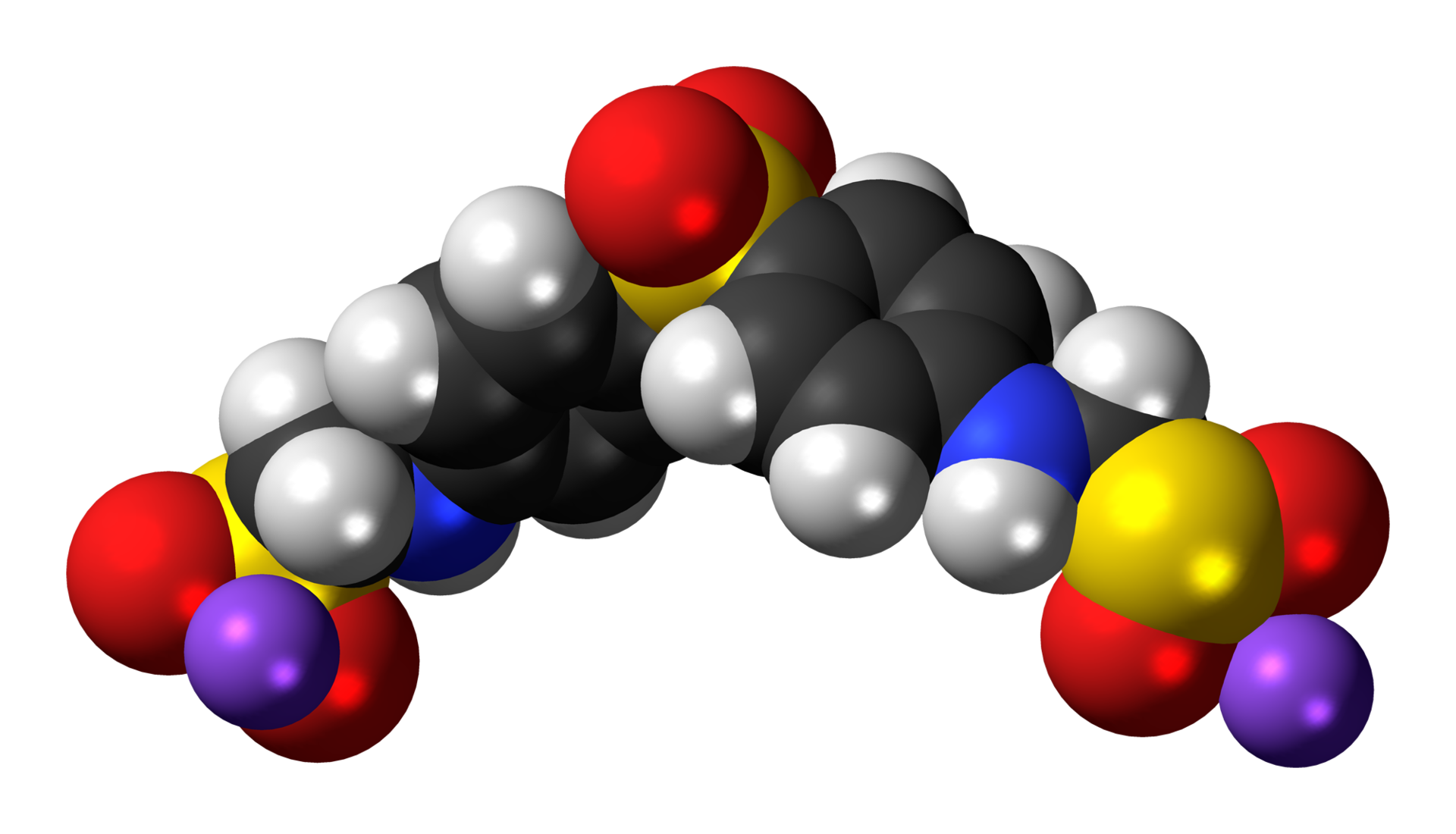 Натриев алдесулфон – антибиотик, използван за лечение на проказа.
Натриев алдесулфон – антибиотик, използван за лечение на проказа.
(цветен код: черно – C, бяло – H, червено – O, синьо – N, лилаво – Na, жълто – S)
 Ако парченце натрий се постави във вана с вода, то не потъва (обяснете защо). Наблюдава се разтапянето му до малко метално топче под действие на отделената при взаимодействието топлина. Топчето „се носи и бяга“ по повърхността на водата, изтласквано от отделения газ водород, който се самозапалва и гори с жълт пламък, оцветен от парите на натрия.
Ако парченце натрий се постави във вана с вода, то не потъва (обяснете защо). Наблюдава се разтапянето му до малко метално топче под действие на отделената при взаимодействието топлина. Топчето „се носи и бяга“ по повърхността на водата, изтласквано от отделения газ водород, който се самозапалва и гори с жълт пламък, оцветен от парите на натрия.

Този опит показва, че натрият взаимодейства буйно с водата. Получава се съединението натриев хидроксид NaOH, отделят се газ водород H2 и топлина.
Протеклата реакция се изразява с химично уравнение.
[latex]\large 2\text{Nа} + 2\text{H}_2\text{O} \xrightarrow[\text{}]{\text{}} \underset{\textcolor{RoyalBlue}{\text{натриев хидроксид}}}{2\text{Nа}\text{OH}}+\text{H}_2[/latex]
Внимание! Натрият не се пипа с ръце, защото реагира с водата от клетките на кожата и предизвиква тежки изгаряния. Той се съхранява в петрол и когато се работи с него, се използват предпазни очила, ръкавици и пинсети.
Взаимодействието на натрий с вода е реакция на химично заместване.
Такъв тип реакция е и взаимодействието на натрий със солна киселина HCl, при което се образува солта натриев хлорид и се отделя газът водород H2.
[latex]\large 2\text{Nа} + 2\text{HCl} \xrightarrow[\text{}]{\text{}} 2\text{NаCl}+\text{H}_2[/latex]
Химична реакция, при която атомите на един химичен елемент заместват атомите на друг химичен елемент от дадено съединение, се нарича химично заместване.
Химичните взаимодействия на натрия Nа с кислород, с други неметали (Cl2, S), с вода и с киселини (HCl) го определят като химически много активен метал.

В горните слоеве на атмосферата на височина от 80 кm е открит слой от пари на натрия. Той се е запазил на тази височина, защото там няма кислород, водни пари или други вещества, с които елементът да взаимодейства.
Кратко обобщение
● Елементът натрий образува просто вещество – метала Na, който е в твърдо състояние. В съединенията си проявява постоянна първа валентност.
● Натрият притежава характерни за металите физични свойства и встъпва в химични взаимодействия с кислород, други неметали (Cl2, S), вода и киселини (HCl), които го определят като химически активен метал.